Übersichtsarbeit
Ilja L. Kruglikov
Dermale Adipozyten in Dermatologie und Ästhetischer Medizin: Fakten und Hypothesen
Dermal adipozytes in dermatology and aesthetic medicine: facts and hypothesese
Keywords | Summary | Correspondence | Literature
Keywords
Dermal adipocytes, hair cycle, scarring, skin aging, skin efflorescences, thermoregulation, wound healing
Schlüsselworte
Dermale Adipozyten, Haarzyklus, Hautalterung, Hauteffloreszenzen, Narbenbildung, Thermoregulation, Wundheilung
Summary
Dermal adipocytes are very special cells which are involved in different physiological and pathological processes in the skin. Application of various exogenous factors can cause a multiple expansion or depletion of this dermal fat depot and modulate its metabolic properties. It can be expected that the future treatment concepts and methods in dermatology and aesthetic medicine will not simply take into account the modulation of the dermal fat depot, but they will be strongly based on this modulation.
Zusammenfassung
Dermale Adipozyten sind ganz spezielle Zellen, die an verschiedenen physiologischen und pathologischen Prozessen in der Haut beteiligt sind. Der Einfluss verschiedener exogener Faktoren kann zur mehrfachen Vergrößerung oder zum Abbau vom dermalen Fettdepot führen. Man kann davon ausgehen, dass neue Behandlungskonzepte und Methoden in der Dermatologie und in der ästhetischen Medizin zukünftig die Wirkungen auf dermale Adipozyten nicht nur berücksichtigen werden, sondern vielmehr auf diesen basiert werden.
Einführung
Die in der Dermatologie und der ästhetischen Medizin etablierten Behandlungsmethoden basieren auf bekannten anatomischen und physiologischen Merkmalen der Haut. Diese Merkmale führen zu gewissen Modellen, die verschiedene Prozesse in der Haut berücksichtigen sollen, z.B. ihre mechanischen Eigenschaften, charakteristischen Turnoverzeiten, Migration von Zellen usw. Einer der wichtigsten Grundprinzipien der Dermatologie setzt voraus, dass die phänotypischen Merkmale der in der Haut angesiedelten Zellen sich im Laufe der Zeit nicht wesentlich verändern, d.h. dass die meisten von diesen Zellen terminal differenziert sind. Demnach muss ein Fibroblast immer ein Fibroblast bleiben und hauptsächlich Kollagen und andere Komponenten der extrazellulären Matrix produzieren, um die Stabilität der Hautstruktur zu garantieren. Wenn aber feststeht, dass epitheliale Zellen sich in mesenchymale Zellen und zurück umwandeln können, dass Myofibroblasten in Wirklichkeit keine terminal differenzierten Zellen sind und sich entsprechend re- oder de-differenzieren können, und dass die Adipozyten (die theoretisch gar nicht in der Haut angesiedelt sein sollten) sich sogar dort in die Myofibroblasten leicht trans-differenzieren lassen, kann die scheinbar „heile“ Welt der Dermatologie ins Wanken geraten. Dann muss früher oder später eine Revision vorgenommen werden.
Es scheint, dass genau so eine Revision in der Dermatologie gerade stattfindet. Schuld daran sind die sogenannten „dermalen Adipozyten“. Adipozyten in der Haut sollten, entsprechend allen bekannten Hautmodellen, eher eine Ausnahme bilden und damit keine wichtige physiologische Rolle spielen. Dafür spricht die kleine Anzahl von diesen Zellen in der Haut (im Vergleich zu solchen Global Players wie Fibroblasten und Keratinozyten) sowie das große Volumen des Kollagennetzwerkes und anderer extrazellulärer Strukturen, die mit Aktivitäten von Adipozyten physiologisch nicht verlinkt sein sollten. Allein aus dieser Tatsache heraus sollte hervorgehen, dass solche Prozesse in der Haut wie z.B. Wundheilung, Narbenbildung oder Hautalterung im besten Fall nur am Rande etwas mit Adipozyten zu tun haben sollten.
Dermale Adipozyten – von Außenseitern zu Global Players?
Es ist schon lange bekannt, dass sich zwei anatomisch unterschiedliche Schichten des adipozytären Gewebes unter der retikulären Dermis befinden. Bei Nagetieren sind diese Schichten durch einen quergestreiften Muskel (sog. panniculus carnosus) voneinander getrennt und somit deutlich sichtbar. In der menschlichen Haut sind dermale Adipozyten auch vorhanden; sie konzentrieren sich allerdings hauptsächlich um die Haarfollikel (HF) herum.
Solche lokalen Ansammlungen von Adipozyten wurden angeblich zuerst im Schweinefötus beschrieben [1] und dann für längere Zeit nicht mehr wirklich untersucht. Später wurden diese Ansammlungen als „dermale Konusse“ bezeichnet [2,3], wobei sich der obere Teil des Konuses in der Dermis und der untere Teil (manchmal auch „Fettkuppel“ genannt) in der Subkutis befinden. Bemerkenswert ist dabei die Tatsache, dass diese Strukturen bei Menschen mosaikförmig und bei Nagetieren in Form von kontinuierlichen parallel verlaufenden Schichten erscheinen. Noch viel interessanter ist jedoch die festgestellte räumliche Korrelation zwischen den „dermalen Konussen“ und der Entstehung von hypertrophen Narben [2]. Dort wo solche Strukturen nicht vorhanden oder stark reduziert sind (z.B., Fötus, Handfläche, Skalp, Stirn), ist die Wahrscheinlichkeit einer Narbenbildung ist deutlich geringer als an solchen Stellen wo diese Strukturen massiv auftreten können (z.B., Wangen, Hals, Brust, Bauch, Rücken, Hüften, Beine, Arme, Handrücken, usw.). Eine Korrelation ist jedoch noch lange kein Beweis, sondern lediglich ein Hinweis, weshalb sie zuerst keine weitere Beachtung fand. Diese Sichtweise hat sich in den letzten Jahren komplett verändert, nachdem festgestellt wurde, dass diese Adipozyten
- eine wichtige (wenn nicht sogar eine entscheidende) Rolle in der Wundheilung spielen [4];
- eine notwendige Bedingung für den vollständigen Haarfollikel (HF)-Zyklus stellen [5];
- mit hoher Wahrscheinlichkeit in Hautalterungsprozesse involviert sind [6];
- eine kutane Fibrosierung und Narbenbildung durch eine früher unbekannte Zelldifferenzierungs-Art bestimmen können [7];
- bei homöostatischer Temperaturregulation der Haut mitwirken [8];
- die erste Immunabwehrlinie gegen Hautinfektionen bilden [9].Adipozyten, die normalerweise sehr träge sind und im subkutanen weißen Fettgewebe (sWAT) einen Umschlagsfaktor von ca. 10 Jahren haben [10], demonstrieren in der Dermis eine viel höhere Dynamik die eher typisch für einen HF-Zyklus oder für die Wundheilung ist. Somit unterscheiden sich dermale Adipozyten stark von konventionellen Adipozyten im sWAT. Auf der anderen Seite, verhalten sich diese Zellen wie „Chimeras“, weil sie unterschiedliche phänotypische Merkmale tragen und damit sich schnell in die anderen Zelltypen umwandeln können [11]. Um diese Unterschiede deutlich zu machen und die Bedeutung der dermalen Adipozyten hervorzuheben, wurde eine neue Fettdepot-Art definiert – dWAT (dermal white adipose tissue) [12,13] (Abb. 1).
Dermale Adipozyten – Einige Fakten
Wundheilung
Es ist allgemein bekannt, dass solche Zellen wie Fibroblasten und besonders die Myofibroblasten eine wichtige Rolle in der Wundheilung spielen. Schließlich sollte in der verletzten Haut eine große Menge der extrazellulären Matrix produziert werden. Dass dermale Adipozyten parallel zu Fibroblasten die Wunde besiedeln und dass dieser Prozess hauptsächlich über Adipogenese realisiert wird, ist allerdings relativ neu [4]. Es wurde gezeigt, dass eine Maus mit genetischer Lipoatrophie (sog. A ZIP/F1 Maus), die systemisch keine reifen Adipozyten besitzt, überraschenderweise eine fehlerhafte Fibroblasten-Neubildung und eine instabile Wundheilung demonstriert, was die Bedeutung von reifen dermalen Adipozyten in diesem Prozess unterstreicht.
Diese positive Wirkung dermaler Adipozyten hat allerdings eine Kehrseite: wenn dermale Adipozyten in die Wundheilung involviert sind, sollten sie auch eine wichtige Rolle in der Narbenbildung spielen.
Narbenbildung
Bisher wurde die Bildung einer kutanen Fibrose nach Wundheilung hauptsächlich mit der fehlenden Apoptose von Myofibroblasten verbunden. Diese Zellen müssen in späteren Phasen der Wundheilung „sterben“, um so eine Überproduktion von Kollagen in der Wunde zu vermeiden. Es wurde bisher angenommen, dass Myofibroblasten aus vorhandenen Fibroblasten oder aus Epithelzellen durch sogenannte epithel-mesenchymale Transdifferenzierung produziert werden können. Diese Transformation sollte reversibel sein, schließlich können sich die Adipozyten auch in Epithelzellen re-differenzieren [14]. Für die Narbenbildung werden sehr synthetisch aktive, kollagenbildende, allerdings unbewegliche Myofibroblasten benötigt. Können diese Myofibroblasten aus Adipozyten produziert werden?
Zwei Jahre nach der Arbeit von Schmidt und Horsley [4] erschien eine wichtige Publikation [7], welche diese Frage positiv beantwortete. Es wurde zuerst demonstriert, dass kutane Fibrose mit dem Verlust von dWAT stark korreliert. Das bedeutet, dass Fettdepot durch Fibrose ersetzt wird. Dann wurde gezeigt, dass Myofibroblasten aus adiponektin-positiven intradermalen Stammzellen produziert werden. Dieser Effekt wurde Adipozyt-Myofibroblast Transformation genannt und es scheint, dass diese neue Art der Zelldifferenzierung eine viel größere Rolle in verschiedenen physiologischen und pathologischen Prozessen spielen kann als es ursprünglich gedacht wurde [11]. Daraus resultiert eine paradoxe Situation: dermale Adipozyten werden essentiell für eine vollständige Wundheilung gebraucht; gleichzeitig, stellen sie wegen ihrer potentiellen Differenzierung in Myofibroblasten ein Risiko der hypertrophen Narbenbildung dar.
Haarzyklus
Es besteht kaum Zweifel, dass dermale Adipozyten sich aktiv am HF-Zyklus beteiligen [5]. Die Präsenz von diesen Zellen scheint nicht nur notwendig sondern auch ausreichend für eine einwandfreie zyklische Entwicklung von Haarfollikeln. In diesem Zusammenhang ist interessant, dass in Föten von Mäusen dWAT sich unabhängig von sWAT entwickelt und diese Entwicklung primär mit der HF-Morphogenese zu tun hat [12]. Das bedeutet, dass die Adipozyten aus dWAT und sWAT sich voneinander deutlich unterscheiden müssen.
Reife Adipozyten und adipöse Stammzellen sind in verschiedenen HF-Phasen unterschiedlich vertreten. So erhöht sich die Anzahl von Präadipozyten in der Mäusehaut während der Anageninduktion um das 4-fache, während sie in der späten Anagenphase auf ihren Normalwert zurückgeht. Reife Adipozyten sind hauptsächlich während der Haarschaft-Entwicklung in der Subphase Anagen VI präsent; ihre Anzahl in der Katagen- und Telogen-Phase ist deutlich reduziert. Dies erklärt teilweise warum die Haarfollikel in der Anagen VI deutlich weniger lichtsensitiv als in anderen Anagenphasen sind [15-18].
Bestehende Korrelation zwischen HF-Phasen und dWAT-Gehalt führt zu einer grundlegenden Veränderung unseres Hautbildes. Weil an solchen Hautstellen wo sich die Haare in der Anagen-Phase befinden dWAT sich im Vergleich mit anderen Stellen vergrößern sollte, ist zu vermuten, dass eine räumlich heterogene Fettverteilung entstehen muss [19]. Das kann zur Bildung der räumlich begrenzten Hautflecken führen, am Rande von welchen sich Gradiente der von Adipozyten gesteuerten parakrinen Signale bilden können. Das sollte die Hautstruktur und dementsprechend auch die Hautfunktionen lateral heterogen machen – ein Aspekt welcher in der Dermatologie sowie in der ästhetischen Medizin nie berücksichtigt wurde.
Homöostatische Thermoregulation
Vor kurzen kam die nächste Überraschung – dWAT sollte in die homöostatische Thermoregulation involviert werden, was Experimente mit der sog. Syndecan-1 Null Maus gezeigt haben [8]. Syndecan-1 ist für adipozytäre Differenzierung notwendig; ohne dieses Protein bleibt das dWAT-Depot stark unterentwickelt. An diesem Model könnte demonstriert werden, dass die Haut mit schneller Involution oder Expansion des dWAT-Depots auf Umgebungsbedingungen reagieren kann. Während sWAT auf milde Kälte normalerweise mit einer Glyzerin-Freisetzung und Produktion von braunen/“beigen“ Adipozyten reagiert, zeigt dWAT bei gleichen Temperaturen eine bis zu 4-fache Verdickung (Abb. 1). Diese Fett-Expansion ist reversibel – nach der Rückkehr zu normalen Temperaturen wird dWAT schnell abgebaut und kommt zu seinen Normalwerten zurück. So ein ungleiches Verhalten von dWAT und sWAT deutet wieder auf unterschiedliche Eigenschaften von Adipozyten aus diesen zwei Depots hin.
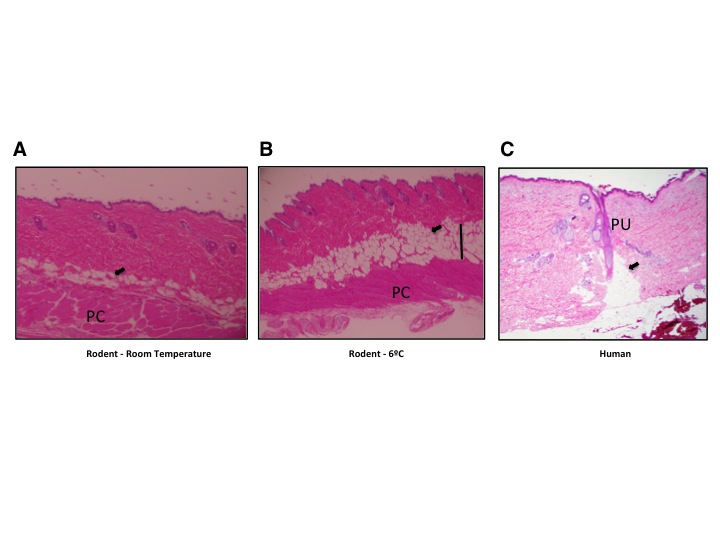
![Abb. 1: Typische dWAT-Strukturen bei Mäusen und Menschen: (A) Dermale Adipozyten in der C57/BI6 Maus bei Raumtemperaturen bilden mehrschichtige Struktur oberhalb der panniculus carnosus. (B) Deutliche Erweiterung der dWAT-Schicht in der C57/BI6 Maus nach einer Kälteexposition (6°C, 4 Tage); (C) Dermale Adipozyten in der menschlichen Haut bilden „dermale Konusse“ um die Haarfollikel herum. (Mit freundlicher Genehmigung von Trends Endocrin Metab [11]).](https://www.kosmetischemedizin-online.de/wp-content/uploads/2016/05/Kruglikov-Abb-1-KM-16-1-300x225.jpg)
Abb. 1: Typische dWAT-Strukturen bei Mäusen und Menschen: (A) Dermale Adipozyten in der C57/BI6 Maus bei Raumtemperaturen bilden mehrschichtige Struktur oberhalb der panniculus carnosus. (B) Deutliche Erweiterung der dWAT-Schicht in der C57/BI6 Maus nach einer Kälteexposition (6°C, 4 Tage); (C) Dermale Adipozyten in der menschlichen Haut bilden „dermale Konusse“ um die Haarfollikel herum. (Mit freundlicher Genehmigung von Trends Endocrin Metab [11]).
Immunabwehr der Haut
Man hat schon lange vermutet, dass Adipozyten immunologisch aktiv sein können. Erst vor kurzem konnte diese Reaktion endlich nachgewiesen werden [9]. Nachdem die Mäusehaut mit S. aureus infiziert wurde, reagierte das Fettgewebe mit einer schnellen Proliferation von Präadipozyten und mehrfacher Verdickung der dWAT-Schicht. Es wurde dabei festgestellt, dass mindestens ein Teil dieser Reaktion durch Hypertrophie der bestehenden Adipozyten zustande kommt. Zusätzlich wurde gezeigt, dass Mäuse mit inhibierter Fettexpansion eine reduzierte Abwehrreaktion auf S. aureus haben. Solch eine Immunabwehr-Reaktion wurde durch die von Adipozyten produzierte Cathelicidine (antimikrobielle Peptide) realisiert. Das kann eine unerwartete Verbindung zwischen dermalen Adipozyten und Hauteffloreszenzen schaffen, weil Cathelicidine eine inflammatorische Wirkung haben können.
Dermale Adipozyten – Einige Hypothesen
Hauteffloreszenzen
An dieser Stelle kann darauf spekuliert werden, ob dermale Adipozyten in die Entwicklung von verschiedenen Hauteffloreszenzen involviert sind [11,20]. Dafür spricht die Tatsache, dass das von Adipozyten produzierte antimikrobielle Peptid Cathelicidin pro-inflammatorisch wirkt und bei Rosazea und Psoriasis ungewöhnlich stark in der betroffenen Haut erhöht ist [21]. Die Produktion von Cathelicidin ist ebenfalls in entzündlichen Hauterkrankungen wie atopische Dermatitis und Psoriasis deutlich verändert [22]. Es ist auch bekannt, dass antimikrobielle Peptide wesentlich in die Pathogenese der Akne involviert sind [23]; Cathelicidin wurde sogar als eine potentielle Therapieoption bei Akne vorgeschlagen [24].
Wenn dWAT im Allgemeinen in die Pathophysiologie von verschiedenen entzündlichen Hauterkrankungen involviert ist, muss an dieser Stelle angenommen werden, dass dWAT in Rosazea und Psoriasis lokal vergrößert sein sollte. So ein Verhalten von adipozytärem Gewebe ist nicht ungewöhnlich, wenn berücksichtigt wird, dass Entzündungen eine lokale Adipogenese stark stimulieren können, weil das für gesunde Remodellierung des Fettgewebes essentiell ist [25]. Die Modulation der dWAT-Dicke wurde bereits in verschiedenen knockout Modellen demonstriert [11]. Vor kurzem wurde auch demonstriert, dass Adiponektin (bekannt als metabolischer Regulator der Insulinsensitivität) in die Entwicklung vor psoriaseförmigen Dermatitis in Maus involviert ist [26]. Viel mehr, die Adiponektin-Null Maus demonstriert eine schwere Form von dieser Erkrankung, was noch einmal auf eine Verbindung zwischen Psoriasis and Adipozyten hindeutet. Zukünftige Untersuchungen sollten zeigen, inwieweit die dWAT-Strukturen tatsächlich in die Pathogenese der verschiedenen Hauteffloreszenzen involviert sind.
Es ist bekannt, dass eine Mehrheit von Hauteffloreszenzen auf gleiche physikalische Faktoren mit einer Hautbildverbesserung reagiert. Vor kurzem wurde so eine unspezifische Reaktion nach der Anwendung des sehr hochfrequenten Ultraschalls (mit Frequenzen von 10 MHz) bei solchen Hauterkrankungen wie Rosazea, Ekzem, Akne und Psoriasis demonstriert [27]. Das deutet darauf hin, dass alle diese Erkrankungen mindestens eine unspezifische pathophysiologische Komponente besitzen müssen. Solche unspezifische Wirkung von sehr hochfrequentem Ultraschall wurde bereits in [27] mit lokaler Regulation von Matrix Metalloproteinasen begründet. Auch wenn die Matrix Metalloproteinasen in der entzündlichen Haut tatsächlich um einige Größenordnungen erhöht sein können, ist diese Erhöhung nicht die primäre Ursache, sondern sollte eher eine Folge der Hauteffloreszenz sein. Wohingegen, eine defekte Cathelicidin-Produktion durch dermale Adipozyten kann als Ursache einer unspezifischen Hautreaktion in Frage kommen.
Hautalterung
Alterungsprozesse sind generell mit Abbau von Fettdepots und steigender lokaler Fibrosierung verbunden. Die adipozytäre Involution kann durch Verkleinerung einzelner Adipozyten, durch Zelltod oder durch Differenzierung von diesen Zellen in andere Zellen (z.B. in Fibroblasten) realisiert werden. Die oben beschriebenen Differenzierungs-Prozesse, bei deren Adipozyten sich in Epithelzellen oder Myofibroblasten verwandeln, sind generell mit lokalen Volumenverlusten des Gewebes verbunden. Ein lokaler korrelierter Verlust (innerhalb einer gewissen charakteristischen Fläche) von „dermalen Konussen“ kann grundsätzlich zu einem flächenbezogenen inhomogenen Abbau der Haut führen. Weil Abbauprozesse in papillarer Dermis und in dWAT parallel oder unabhängig voneinander verlaufen können, sollte an dieser Stelle vermutet werden, dass die Hautalterung in verschiedenen Formen auftreten kann.
Dafür gibt es einige starke Argumente. Eine chronische UV-Bestrahlung von haarlosen Mäusen produziert keine Verdickung von Dermis, induziert allerdings eine signifikante Involution von dWAT mit der Bildung von Fibrose und Akkumulierung von Hyaluronan [28]. In einem anderen Experiment wurden die Mäuse chronisch mit UVA bestrahlt [29]. Auch in diesem Fall wurden eine deutliche Reduktion der dWAT-Schicht (allerdings erst nach 8 Wochen Bestrahlung) sowie eine Fibrosierung beobachtet. Weil in beiden Experimenten keine Verdickung der Dermis stattgefunden hat, kann angenommen werden, dass (zumindest im Fall einer photoinduzierten Hautalterung) die oben beschriebenen Prozesse der Adipozyt-Myofibroblast Transformation eine wichtige pathophysiologische Rolle spielen. Das sollte bedeuten, dass die UV-Bestrahlung eine Transdifferenzierung von dermalen Adipozyten und ihre Umwandlung in die synthetisch aktiven Myofibroblasten initiieren kann. Falls diese Annahme korrekt ist, kann das die gesamte Hauptthese der Hautalterung in Frage stellen und die Hauptinteresse in Anti-Aging vom Bindegewebe hin zu der oberflächlichen Schicht der Subkutis verschieben.
Effektive Korrekturen bei der Hautalterung sollten auch Prozesse im Fettgewebe beeinflussen können. Es wurde vor kurzem argumentiert, dass weit verbreitete Weichgewebe-Filler primär nicht auf die Kollagenproduktion sondern vielmehr auf Adipogenese wirken sollten [30,31]. Das konnte nicht nur die schnelle sondern auch die langfristige Hautbildverbesserung nach Anwendung solcher Filler erklären, fordert allerdings eine grundsätzliche Revision der Anwendungsabläufen. Es kann daraus vermutet werden, dass eine optimale Filler-Anwendung keine stand-alone Behandlung sein sollte, sondern eine spezielle Vorbehandlung der Rezipienten-Stelle in den Behandlungsablauf implementiert werden müsste.
Hyper- und Hypopigmentierungen der Haut
Die Pathophysiologie des Melasmas basiert auf einer lokalen Überaktivität von Melanozyten in der Epidermis, welche traditionell mit UV-Bestrahlung erklärt werden [32]. Melanozyten können allerdings nicht nur direkt durch UV-Licht, sondern auch durch parakrine Signale beeinflusst werden. Diese Signale werden mittels Diffusion übertragen, was ihre charakteristische Wirkungslänge stark begrenzt. Um auf die Melanozyten effektiv wirken zu können, müssen die signalproduzierenden Zellen nicht weit von der Epidermis entfernt werden.
Eine wichtige ungeklärte Eigenschaft der Hyperpigmentierung ist ihr mosaikförmiger Charakter – Pigmentflecken sind deutlich größer als einzelne Melanozyten und ihre Bildung verlangt eine kooperative Reaktion von Melanozyten auf einer charakteristischen Fläche. Diese Eigenschaft wurde in [33] mit der Funktion der Epithelzellen verbunden. Vor kurzem wurde allerdings argumentiert, dass dermale Adipozyten in Hyper- und Hypopigmentierungen der Haut eine wichtige Rolle spielen können [11].
Es ist bekannt, dass die Stammzellen aus dem Fettgewebe die Melanin-Produktion sowohl in vitro [34] als auch in vivo (bei intradermalen Injektionen) [35] unterdrücken können, was mit einer Sekretion von TGF-β1 erklärt werden kann. TGF-β1 ist ein bekannter Parakrin-Mediator welcher auch die Expressionsprofile von Hyaluronsäure und verschiedenen Kollagenen in der Haut bestimmt [36]. Gleichzeitig unterdrückt TGF-β1 die Produktion von Tyrosinase, was zur Inhibierung der Melanin-Synthese führen sollte. Das bedeutet, dass dWAT grundsätzlich in die Regulation von Melanin-Produktion involviert sein kann. Weil die Fleckengröße bei Melasma oder bei post-inflammatorischen Hyperpigmentierungen die Dimension einzelner Melanozyten sowie einzelner dWAT-Strukturen weit überschreiten, stellt sich an dieser Stelle die Frage, ob die Hyperpigmentierungen nicht mit dem Verlust der TGF-β1 Produktion in dWAT-Elementen innerhalb eines charakteristischen Haut-Clusters zusammenhängt [19]?
Mögliche Konsequenzen für Behandlungskonzepte in der Dermatologie und in der ästhetischen Medizin
Weil besondere Eigenschaften von dermalen Adipozyten nicht weiter ignoriert werden können, ist zu vermuten, dass zukünftig grundlegende Veränderungen in einigen dermatologischen und ästhetischen Behandlungskonzepten zu erwarten sind. Physikalische Faktoren, die adipöse Stammzellen und reife Adipozyten modulieren können, verhalten sich in einigen Fällen ähnlich zu solchen Faktoren, die zur Neokollagenese-Stimulation verwendet werden. Auf der anderen Seite, gibt es hier auch große Unterschiede. Beispielsweise kann die Stimulation von Adipozyten durch mechanischen Stress, milde Wärme und Kälte hervorgerufen werden, wobei die Stärke dieser Stimulation sehr parameterabhängig erscheint. Kältebehandlungen führen allerdings nicht zu einer Kollagenstimulation – hier kann man die Unterschiede deutlich erkennen.
Eine Besonderheit der Stimulation von dermalen Adipozyten liegt darin, dass sie sich an der Grenze Dermis / Subkutis befinden. Eine optimale Stimulation von diesen Zellen fordert somit die Konzentration von stimulierenden Kräften in dieser Region, was für eine variable Dicke der Dermis innerhalb eines Behandlungsareals und besonders bei verschiedenen Patienten keine einfache Aufgabe sein wird. Wahrscheinlich wird sich damit der therapeutische Interessenbereich erstmals vom bestimmten Gewebsvolumen auf eine Grenzschicht reduzieren.
Solcher Paradigmenwechsel kann dazu führen, dass verschiedene dermatologische und ästhetische Indikationen nicht mit eigenständigen, sondern nur mit gewissen Kombinationsmethoden optimal behandelt werden können. Darüber hinaus ist anzunehmen, dass eine optimale Stimulation von dermalen Adipozyten eine deutlich erhöhte Behandlungshäufigkeit verlangt und somit ambulant eher suboptimal realisiert werden kann. Demnach sollten die Patienten zukünftig stärker in den Behandlungsprozess involviert werden.
Zusammenfassung
Dermale Adipozyten sind ganz spezielle Zellen, die an verschiedenen physiologischen und pathologischen Prozessen in der Haut beteiligt sind. Diese Zellen können sich schnell aus Fettgewebe-Stammzellen entwickeln; auf der anderen Seite können sie sich in Epithelzellen oder Fibroblasten umwandeln, was für ihre große Plastizität spricht. Dermale Adipozyten demonstrieren eine Dynamik mit einem Umschlagsfaktor, der bis zu 1.000-fach höher sein kann, als es für die subkutanen Adipozyten üblich ist. Die Reaktion von dWAT auf verschiedene exogene Faktoren kann zur mehrfachen Vergrößerung oder Abbau des Depots führen, was nicht nur Auswirkungen auf dermatologische, sondern auch auf die ästhetischen Indikationen zeigen sollte.
Man kann davon ausgehen, dass neue Behandlungskonzepte und Methoden in der Dermatologie und in der ästhetischen Medizin zukünftig die Wirkungen auf dermale Adipozyten nicht nur berücksichtigen sollten, sondern vielmehr auf diesen basiert werden. Weil optimale Wirkungen auf Kollagenstrukturen der Haut und dermale Adipozyten höchstwahrscheinlich nur mit verschiedenen physikalischen Methoden und bei Anwendung von unterschiedlichen Behandlungsparametern erzielt werden können, kann jetzt schon vermutet werden, dass verschiedene dermatologische und ästhetische Indikationen nicht mit eigenständigen, sondern nur mit gewissen Kombinationsmethoden optimal behandelt werden können.
Korrespondenz-Adresse
Dr. rer. nat. habil. Ilja L. Kruglikov
Wellcomet GmbH
Greschbachstr. 2-4
D-76229 Karlsruhe
E-mail: i.kruglikov@wellcomet.de
Conflict of Interests
Dr. I. Kruglikov is the managing partner of Wellcomet GmbH
Literatur
1. Hausman GJ, Martin RJ (1982) The development of adipocytes located around hair follicles in the fetal pig. J Animal Sci 54: 1286-1296.
2. Matsumura H, Engrav LH, Gibran NS, Yang TM, Grant JH, Yunusov MY, Fang P, Reichenbach DD, Heimbach DM, Isik FF (2001) Cones of skin occur where hypertrophic scar occurs. Wound Repair Regen 9: 269-277.
3. Engrav LH, Tuggle CK, Kerr KF, Zhu KQ, Numhom S, Couture OP, Beyer RP, Hocking AM, Carrougher GJ, Ramos MLC, Klein MB, Gibran NS (2011) Functional genomics unique to week 20 post wounding in the deep cone/fat dome of the Duroc/Yorkshire porcine model of fibroproliferative scarring. PloS ONE 6: e19024.25.
4. Schmidt BA, Horsley V (2013) Intradermal adipocytes mediate fibroblast recruitment during skin wound healing. Develop 140: 1517-1527.
5. Festa E, Fretz J, Berry R, Schmidt BA, Rodeheffer M, Horowitz M, Horsley V (2011) Adipocyte lineage cells contribute to the skin stem cell niche to drive hair cycling. Cell 146: 761-771.
6. Rivera-Gonzalez G, Shook B, Horsley V (2014) Adipocytes in Skin Health and Disease. Cold Spring Harbor Pers Medicine 4: a015271.
7. Marangoni RG, Korman BD, Wei J, Wood TA, Graham LV, Whitfield ML, Scherer PE, Tourtellotte WG, Varga J (2015) Miofibroblasts in cutaneous fibrosis originate from adiponectin-positive intradermal progenitors. Arthrit Rheumatol 67: 1062-1073.
8. Kasza I, Suh Y, Wollny D, Clark RJ, Roopra A, Colman RJ, MacDougald OA, Shedd TA, Nelson DW, Yen MI, Yen CLE, Alexander CM (2014) Syndecan-1 is required to maintain intradermal fat and prevent cold stress. PLoS Genet 10: e1004514.
9. Zhang LJ, Guerrero-Juarez CF, Hata T, Bapat SP, Ramos R, Plikus MV, Gallo RL (2015) Dermal adipocytes protect against invasive Staphylococcus aureus skin infection. Science 347: 67-71.
10. Spalding KL, Arner E, Westermark PO, Bernard S, Buchholz BA, Bergmann O, Blomqvist L, Hoffstedt J, Näslund E, Britton T, Concha H, Hassan M, Ryden M, Frisen J, Arner P (2008) Dynamics of fat cell turnover in humans. Nature 453: 783-787.
11. Kruglikov IL, Scherer PE (2015) Dermal adipocytes: from irrelevance to metabolic targets? Trends Endocrin Metabol 27: 1-10.
12. Wojciechowicz K, Gledhill K, Ambler CA, Manning CB, Jahoda CAB (2013) Development of the mouse dermal adipose layer occurs independently of subcutaneous adipose tissue and is marked by restricted early expression of FABP4. PloS ONE 8: e59811.
13. Driskell RR, Jahoda CAB, Chuong CM, Watt FM, Horsley V (2014) Defining dermal adipose tissue. Exp Dermatol 23: 629–631.
14. Morroni M, Giordano A, Zingaretti MC, Boiani R, De Matteis R, Kahn BB, Nisoli E, Tonello C, Pisoschi C, Luchetti MM, Marelli M, Cinti S (2004) Reversible transdifferentiation of secretory epithelial cells into adipocytes in the mammary gland. Proc Nat Acad Sci 101, 16801-16806.
15. Kruglikov IL (2012a) Melanin light absorption as the necessary but not sufficient condition for photoepilation: Intra-anagen variability of hair follicle light sensitivity. Am J Cosm Surg 29: 266-272.
16. Kruglikov IL (2012b) Kontroversen in der ästhetischen Medizin: 2. Simplex sigillum veri der Photoepilation. Kosmet Med 33: 238-242.
17. Kruglikov IL (2013) Melanin light absorption as the necessary but not sufficient condition for photoepilation: miniaturization and eclipse phenomena. Am J Cosmet Surg 30: 21-27.
18. Kruglikov IL (2016) Possible role of dermal adipocytes in intra-anagen variation of hair follicle light sensitivity. Am J Cosmet Surg 33. To be published.
19. Kruglikov IL, Scherer PE (2016) Dermal adipocytes and hair cycling: Is spatial heterogeneity a characteristic feature of the dermal adipose tissue depot? Exper Dermatol 25: 258-262.
20. Kruglikov IL, Scherer PE, Wollina U (2016) Are dermal adipocytes involved in psoriasis? Exp Dermatol doi: 10.1111/exd.12996.
21. Yamasaki K, Di Nardo A, Bardan A, Murakami M, Ohtake T, Coda A, Dorschner RA, Bonnart C, Descargues P, Hovnanian A, Morhenn VB, Gallo RL (2007) Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea. Nature Med 13: 975-980.
22. Reinholz M, Ruzicka T, Schauber J (2012) Cathelicidin LL-37: an antimicrobial peptide with a role in inflammatory skin disease. Ann Dermatol 24: 126-135.
23. Harder J, Tsuruta D, Murakami M, Kurokawa I (2013) What is the role of antimicrobial peptides (AMP) in acne vulgaris? Exp Dermatol 22: 386-391.
24. Wang Y, Zhang Z, Chen L, Guang H, Li Z, Yang H, Li J, You D, Yu H, Lai R (2011) Cathelicidin-BF, a snake cathelicidin-derived antimicrobial peptide, could be an excellent therapeutic agent for acne vulgaris. PLoS ONE 6: e22120.
25. Asterholm IW, Tao C, Morley TS, Wang QA, Delgado-Lopez F, Wang ZV, Scherer PE (2014) Adipocyte inflammation is essential for healthy adipose tissue expansion and remodeling. Cell Metabol 20: 103-118.
26. Shibata S, Tada Y, Hau CS, Mitsui A, Kamata M, Asano Y, Sugaya M, Kadono T, Masamoto Y, Kurokawa M, Yamauchi T, Kubota N, Kadowaki T, Sato S (2012) Adiponectin regulates psoriasiform skin inflammation by suppressing IL-17 production from γδ-T cells. J Immunol 6: 7687.
27. Kruglikov IL (2015b) Sehr hochfrequenter Ultraschall als neues Therapieverfahren in der Ästhetik und Dermatologie. Hautarzt 66:829–833.
28. Mitani H, Koshiishi I, Toyoda H, Toida T, Imanari T. (1999) Alterations of hairless mouse skin exposed to chronic UV irradiation and its prevention by hydrocortisone. Photochem Photobiol 69: 41–46.
29. Sayama A, Soushin T, Okada T, Doi K, Nakayama H (2010) Morphological and biochemical changes during aging and photoaging of the skin of C57BL/6J mice. J Toxicol Pathol 23: 133-139.
30. Wollina U (2015) Midfacial rejuvenation by hyaluronic acid fillers and subcutaneous adipose tissue – A new concept. Med Hypoth 84: 327-330.
31. Kruglikov IL, Wollina U (2015a) Soft tissue fillers as non-specific modulators of adipogenesis: change of paradigm? Exp Dermatol 24:912-915.
32. Goorochurn R, Viennet C, Granger C, Fanian F, Varin-Blank N, Le Roy C, Humbert P. (2016) Biological processes in solar lentigo: insights brought by experimental models. Exp Dermatol doi: 10.1111/exd.12937.
33. Weiner L, Fu W, Chirico WJ, Brissette JL (2014) Skin as a living coloring book: how epithelial cells create patterns of pigmentation. Pigment Cell Melanoma Res 27: 1014-1031.
34. Kim WS, Park SH, Ahn SJ, Kim HK, Park JS, Lee GY, Kim KJ, Whang KK, Kang SH, Park BS, Sung JH (2008) Whitening effect of adipose-derived stem cells: A critical role of TGF-beta1. Biol Pharm Bull 31: 606-610.
35. Chang H, Park JH, Min KH, Lee RS, Kim EK (2014) Whitening effects of adipose-derived stem cells: a preliminary in vivo study. Aesth Plast Surg 38: 230-233.
36. Jung H, Kim HH, Lee DH, Hwang YS, Yang HC, Park JC (2011) Transforming growth factor-beta 1 in adipose derived stem cells conditioned medium is a dominant paracrine mediator determines hyaluronic acid and collagen expression profile. Cytotech 63: 57-66.


