Übersichtsarbeit
Dirk Pappai, Hans-Joachim Schulze
Diagnose und Therapie der kongenitalen Naevuszellnaevi
Diagnosis and Therapy of congenital melanocytic naevi
Keywords | Summary | Correspondence | Literature
Keywords
Congenital nevus cell nevi, kNZN, melanoma risk, neurocutaneous melanosis, nevmelanocytes
Schlüsselworte
kNZN, Kongenitale Naevuszellnaevi, Melanomrisiko, Naevmelanozyten, neurokutane Melanose
Summary
Congenital nevus cell nevi (kNZN) (syn.: congenital/congenital pigment or nevus cell nevus, N. pigmentosus et papillomatosus et/sive pilaris) are benign neoplasms composed of nevomelanocytes that already pre-exist at birth. However, not all kNZN are apparent at birth, but become visible in the first weeks of life and can be gigantic in size [1]. Stigmatization in later life, often associated with significant psychosocial distress, and the risk of malignant transformation require a diagnosis-adapted therapeutic strategy [2]. The manifestation of congenital giant nevi, also known as melanophakomatosis when combined with "satellite" nevi, also involves the risk of CNS involvement (neurocutaneous melanosis, leptomeningeal melanocytosis) with formation of CNS melanomas when occurring in the head/neck region. Therefore, a close cooperation of dermatologists, pediatricians, neurologists, radiologists and ophthalmologists is desirable.
Zusammenfassung
Kongenitale Naevuszellnaevi (kNZN) (syn.: kongenitaler/konnataler Pigment- oder Naevuszellnaevus, N. pigmentosus et papillomatosus et/sive pilaris) sind bereits bei Geburt präexistente, aus Naevomelanozyten zusammengesetzte, benigne Neoplasien. Nicht alle kNZN sind jedoch bei Geburt zu erkennen, sondern werden erst in den ersten Lebenswochen sichtbar und können gigantische Ausmaße annehmen [1]. Die Stigmatisierung in späteren Lebensabschnitten, oft verbunden mit einer erheblichen psychosozialen Belastung, und das Risiko der malignen Transformation verlangen eine befundadaptierte Therapiestrategie [2]. Die Manifestation kongenitaler Riesen-NZN, bei Kombination mit „Satelliten"-Naevi auch als Melanophakomatose bezeichnet, beinhaltet bei Auftreten im Kopf-/Hals-Bereich zudem das Risiko einer ZNS-Beteiligung (neurokutane Melanose, leptomeningeale Melanozytose) mit Ausbildung von ZNS-Melanomen. Wünschenswert ist daher eine enge Zusammenarbeit von Dermatologen, Pädiatern, Neurologen, Radiologen und Ophthalmologen.
Epidemiologie
Bei 1 bis 3% aller Neugeborenen der weißen Bevölkerung werden kNZN beobachtet [1, 3]. In Abhängigkeit von der Größe der Läsion im Erwachsenenalter und Population reduziert sich die lnzidenz (kNZN >10 cm: <1/20.000, kNZN > 20 cm: 1/500.000) [4, 5]. Mit zunehmendem Alter steigt die Prävalenz bis auf 18% im Erwachsenenalter. Zumeist sind sie klein (Durchmesser 1 bis 3 cm) und solitär (90%). Genetisch wird ein autosomal dominanter Erbgang mit variabler Penetranz diskutiert. Eine Geschlechtsprädilektion besteht nicht.
Klinik
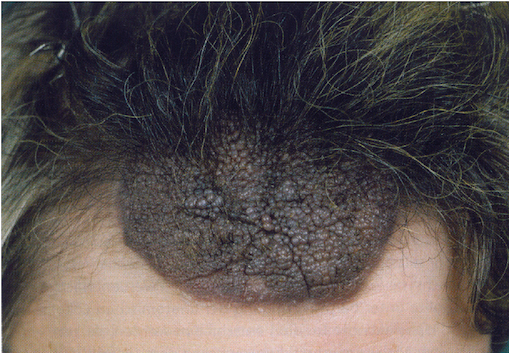
Die kNZN durchlaufen hinsichtlich ihres klinischen Erscheinungsbildes einen charakteristischen Entwicklungsprozess. Bei Säuglingen zeigen sich meist scharf begrenzte, symmetrisch konfigurierte, homogen hellbraun pigmentierte Makulae oder flach erhabene Plaques. Postpartal vollzieht sich eine proportionale Größenzunahme entsprechend des Körperwachstums. Histogenetisch ist neben der horizontalen Flächenausdehnung vor allem die vertikale Ausbreitung relevant, da Naevuszellverbände bereits in den ersten Lebenswochen in tiefe Gewebeschichten einwandern. Hierbei kommt es zu einer Ausbreitung und Umscheidung entlang der Adnexe, Nerven- und Gefäßstrukturen. Diese Dynamik ist vor allem bei großen kNZN für eine rasche therapeutische Intervention innerhalb der ersten sechs Lebenswochen von praktischer Relevanz, da zu einem späteren Zeitpunkt die Naevuszellverbände einer Oberflächentherapie nicht mehr zugängig sind. Im weiteren Verlauf zeigt sich in variabler Ausprägung häufig eine homogen hellbraun-braunschwarze Pigmentierung mit zum Teil fleckiger Sprenkelung, eine verstärkte Behaarung mit Lanugo- oder Terminalhaaren, eine Vergröberung der Hauttextur mit lederartiger Oberfläche und verruköser Hypertrophie. Bei tiefer Durchsetzung mit Naevuszellverbänden bis in die Muskulatur entwickeln sich in Folge der unterbrochenen Kontinuität des Koriums knotige, lobuläre bis zerebriforme Formationen (Kapillitium: Cutis verticis gyrata). Zur Beurteilung der Dignität haben sich neben dem klinischen Bild (ABCD-Regel), im Einzelfall ergänzt durch die Verlaufsdokumentation im Foto, vor allem die Auflichtmikroskopie und die digitale Dermatoskopie [6] mit unterstützender Bildanalyse bewährt. Auflichtmikroskopische Malignitätskriterien sind ein irreguläres grobtrabekuläres Pigmentnetz, Pigmentnetzabbrüche, radiäre Ausläufer, Pseudopodien, „black dots“, ,,weiße Schleier“, grau-blaue Areale und braune Globuli [7].
Histopathologie
Bei kNZN vom „superfiziellen“ Typ liegt unter der Epidermis ein schmaler, naevuszellarmer Bindegewebsstreifen, darunter im oberen Koriumdrittel ein breites Band aus Naevuszellnestern und -strängen; senkrecht zu diesem reichen vertikale Zellstränge entlang den Haarfollikeln und Drüsengängen teilweise bis in das untere Koriumdrittel. Demgegenüber weisen kNZN vom „tiefen“ Typ eine oft wulstig elevierte Oberfläche auf, dermale und subkutane Naevuszellformationen unterbrechen diffus die Kontinuität in allen Schichten.
Als intermediärer Typ ist der kNZN vom „Patchy“-Typ anzusehen, bei dem zusätzlich zu den Veränderungen wie bei dem „oberflächlichen“ Bautyp mittlere und tiefe Koriumabschnitte fleckförmig von Naevuszellverbänden durchsetzt werden.
Klassifikation
Die kNZN werden wegen ihres unterschiedlichen Entartungsrisikos und der hieraus resultierenden Therapieempfehlung in der Regel nach ihrer Größenausdehnung im Erwachsenenalter klassifiziert. Dabei ist zu berücksichtigen, dass der Durchmesser vom Säuglings- zum Erwachsenenalter um den Faktor 2 (Kopf) bis 5 (Extremitäten) zunimmt. Es existieren zahlreiche Einteilungen, wobei eine Orientierung an den Empfehlungen von Kopfetal [8] in Übereinstimmung mit der Empfehlung der FDA angeraten wird [1]:
- Kleiner kNZN: Durchmesser < 1,5 cm
- Mittelgroßer kNZN: Durchmesser < 1,5 bis 19,9 cm
- Großer/Riesen-kNZN: Durchmesser ³ 20 cm.
In älteren Arbeiten haben lllig et al. [9] und Hundeiker [10] berichtet, dass das Risiko einer malignen Transformation weniger von dem absoluten Durchmesser, sondern von der histopathologischen Differenzierung in einen „superfiziellen“ und „tiefen“ Bautyp und deren Übergangsformen abhängig ist. Der „tiefe“ Bautyp ist in der Regel bei großen/Riesen-kNZN nachzuweisen, kommt jedoch auch in kleinen Naevi vor und weist ein höheres Entartungsrisiko bereits im Kindesalter auf.
Weitere Einteilungen [11] beziehen sich auf:
- Relative Größe der Läsion, verglichen zur betroffenen anatomischen Region
- Prozent der Körperoberfläche, die von der Läsion bedeckt ist
- Schwierigkeitsgrad, assoziiert mit Exzision/Ausmaß des Oberflächendefektes.
Melanomrisiko und Therapiestrategien
Alle kNZN werden unabhängig von ihrer Größe als Präkursor-Läsionen eines malignen Melanoms angesehen [3, 9, 11, 12]. Nach neueren Erkenntnissen kennen wir vier Prognosefaktoren für eine maligne Transformation [2]:
- Tumorgröße
- Histopathologischer Bautyp
- Anatomische Lokalisation (Kopf/Hals> Extremitäten > Rumpf)
- Ulzeration.
Alvarez-Mendoza et al. [13] beschreiben darüber hinaus eine mögliche Abschätzung des Melanomrisikos durch Flow-zytometrische DNS- und Zellzyklus-Untersuchungen. Papp et al. [14] fanden in Mutationsanalysen überproportional häufig überaktivierte Punktmutationen im N-ras-Onko gen sowie weitere Mutationen auf dem MC1R- und p53-Gen.
Basierend auf dem in der neueren Literatur übereinstimmend formulierten Erkenntnisstand, dass das Melanomrisiko mit der Größenausdehnung eines kNZN steigt, lassen sich folgende Therapieempfehlungen ableiten: Kleine kNZN (Durchmesser < 1,5 cm), die histopathologisch in der Regel mit einer superfiziellen Ausbreitung der Naevuszellen assoziiert sind, entarten sehr selten (< 1%), so dass engmaschige klinische Verlaufskontrollen zunächst bis zum 10. Lebensjahr empfohlen werden. Nach diesem Zeitpunkt sollte unter Berücksichtigung der anatomischen Lokalisation über eine prophylaktische Exzision entschieden werden, da zum einen das Risiko einer Melanomentwicklung zwischen dem 12. und 15. Lebensjahr sprunghaft ansteigt [15], zum anderen die Kinder in diesem Alter bereits verständig sind. Therapie der Wahl ist bei kleinen Läsionen die Exzision in sano [16].
Statistische Daten zu mittelgroßen kNZN (Durchmesser 1,5 bis 19,9 cm) sind nur in begrenztem Umfang vorhanden [17].
Das Entartungsrisiko wird mit 1 bis 5% angegeben. Regelmäßige klinische Kontrollen, ggf. Biopsien aus verdächtigen Arealen zum Ausschluss eines ,,tiefen“ Bautyps sowie prophylaktische Serienexzisionen sind Therapie verfahren der Wahl (Abb. 1 bis 3).
Die seltenen großen/Riesen-kNZN (Durchmesser ³ 20 cm), die meist mit tiefdermal lokalisierten Naevuszellen assoziiert sind [9, 10, 18], zeigen mit 5 bis 10% einerseits das höchste Entartungsrisiko [19], stellen andererseits aufgrund des häufig ästhetisch entstellenden Hautbefundes und der daraus resultierenden psychosozialen Unzufriedenheit hohe Anforderungen an den Operateur [20, 21]. Bei klinischem Verdacht auf einen großen/Riesen-kNZN sollte unmittelbar postpartal ein dermatochirurgisches Zentrum konsultiert werden, da abhängig von der Tiefenausdehnung der Naevuszellen lediglich in den ersten zwei (bis maximal sechs) Wochen eine hochtourige Dermabrasion mit der Diamant- oder Karbon rundfräse oder Kürettage zu einem zufriedenstellenden kosmetischen und funktionalen Ergebnis führen kann [22 – 25]. Diese „blinde“ Oberflächentherapie verhindert nicht, dass in der tiefen Dermis oder Subkutis Reste des kNZN verbleiben, so dass wir auch im Kindes- und Erwachsenenalter regelmäßige Verlaufskontrollen zum Ausschluss einer malignen Transformation empfehlen. Andererseits gehen wir davon aus, dass mit einer Dermabrasion diejenige Fraktion von Melanozyten in der Junktionszone der Epidermis abgetragen und entfernt wird, von der in den allermeisten Fällen ein malignes Melanom in kNZN ausgeht. Nach der sechsten Lebenswoche kommen andere operative Maßnahmen zur Anwendung. Auch hier gilt, dass unter Abwägung der Operabilität und Ästhetik möglichst frühzeitig operativ interveniert werden sollte, da Melanome bereits im Kindesalter vorkommen, bei tiefdermaler Lokalisation häufig unbemerkt beginnen und bemerkenswerterweise oft einen aggressiveren Verlauf mit meist letalem Ausgang nehmen [26 – 28].
Kaplan [11] unterscheidet ätiologisch drei Melanomentitäten in großen kNZN:
- Melanomentwicklung in der Junktionszone der Epidermis
- Melanomentwicklung aus tiefdermalen neurogenen Anteilen
- Melanomentwicklung in blauen Naevuszellnaevi.
Die kNZN in axialer Lokalisation scheinen mit einer erhöhten Melanom inzidenz einherzugehen [29]. Gosain et al. [30] haben den Versuch unternommen, Algorithmen für das Therapiemanagement zu erstellen: Unter Berücksichtigung der anatomischen Region kommen Serienexzisionen und Exzisionen mit plastisch rekonstruktivem Defektverschluss mittels Hautexpandertechniken sowie vorgedehnten freien Vollhaut und Spalthauttransplantaten zur Anwendung. Aus kosmetischer Indikation werden auch lasertherapeutische Verfahren (Rubin-, Alexandrit-, Neodym-YAG- oder Kohlendyoxid-Laser) angeboten, die jedoch aus Sorge vor einer laserinduzierten malignen Transformation und der Rezidivrate nur mit äußerster Zurückhaltung angewendet werden sollen [31, 32].
Neurokutane Melanose
Die neurokutane Melanose (Virchow-Rokitansky-Touraine) ist definiert als Syndrom, bei dem große/Riesen-kNZN mit einer leptomeningealen Melanose assoziiert sind [33]. Neben der Entwicklung einer neurologischen Symptomatik, die in etwa 10% der Fälle beobachtet wird, können sich auch bei asymptomatischer neurokutaner Melanose leptomeningeale Melanome ausbilden [34 – 36]. Zur frühzeitigen Detektion sollte daher bei allen Patienten mit großen/Riesen-kNZN vor allem im Kopf/Hals Bereich eine radiologische Diagnostik mittels Kernspintomographie erfolgen. Charakteristische Untersuchungsbefunde sind eine T1-Verkürzung in Kleinhirn-Temporallappen, Pons und Medulla sowie eine leptomeningeale Verdickung [37].
Neurologische Symptome, die in der Regel bei posteriorer axialer Lokalisation des Naevus (Kopf, Nacken, Rücken, Gesäß) sowie bei einer Melanophakomatose beobachtet werden, sind durch eine Hirndrucksymptomatik und Masseneffekte bedingt und weisen eine schlechte Prognose auf. Dies betrifft auch Patienten mit einer Dandy-Walker-Maiformation, einer zystischen Fehlbildung des IV. Ventrikels. Weiterhin sind ophthalmologische Konsiliaruntersuchungen mit Augenhintergrundbeurteilung zum Ausschluss einer okulären Melanose oder einer manifesten Hirndrucksymptomatik indiziert.
zusammenfassend stellen kNZN eine Entität angeborener melanozytärer Veränderungen dar, die von umschriebenen Hypermelanosen, Cafe-au-lait Flecken, epidermalen Naevi und kongenitalen malignen Melanomen abzugrenzen sind.
Eine frühzeitige Diagnose ist zur Einleitung eines befundadaptierten Therapiemanagements von entscheidender Bedeutung. Vor allem bei großen/Riesen-kNZN im Kopf/Hals-Bereich ist eine frühzeitige und enge interdisziplinäre Zusammenarbeit zwischen Dermatologen und Dermato-Chirurgen, Pädiatern, Neurologen, Radiologen und Ophthalmologen anzustreben [27].
Korrespondenz-Adresse
Priv.-Doz. Dr. Hans-Joachim Schulze
Ärztlicher Direktor / Chefarzt
Leiter Hauttumorzentrum Hornheide-Münster &
Onkologisches Zentrum MAgKs
Dorbaumstraße 300
DE-48157 Münster
info@magks.net
Conflict of Interests
Es besteht kein Interessenkonflikt.
Literatur
1. Consensus Development Conference of the National Institutes of Health (1984) Precursors to malignant melanoma. JAMA 251: 1864-1866.
2. Marghoob AA (2002) Congenital melanocytic nevi. Evaluation and management. Dermatol Clin 20: 607-616.
3. Richardson SK, Tannous ZS, Mihm MC Jr (2002) Congenital and infantile melanoma: review of the literature and report of an uncommon variant, pigment-synthesizing melanoma. J Am Acad Dermata! 47: 77-90.
4. Baader W, Kropp R, Tapper D (1992) Congenital malignant melanoma. J Plast Reconstr Surg 90: 53-56.
5. Castilla EE, da Graca Dutra M, Orioli-Parreiras IM (1981) Epidemiology of congenital pigmented naevi: incidence rates and relative frequencies. Br J Dermatol 104: 307-315.
6. Braun RP, Calza AM, Krischer J, Saurat JH (2001) The use of digital dermatoscopy for the follow-up of congenital nevi: a pilot study. Pediatr Dermatol 18: 277-281.
7. Stolz W, Riemann A, Cognetta AB, Pillet L, Abmayr W, Hölzel D, Bilek P, Nachbar F, Landthaler M, Braun-Falco O (1994) ABCD rule of dermatoscopy: a new practical method for early recognition.
8. Kopf AW, Bart RS, Hennesey P (1979) Congenital nevocytic nevi and malignant melanomas. J Am Acad Dermatol 1: 123-130.
9. lllig L, Weidner F, Hundeiker M, Gartmann H, Biess B, Leyh F, Paul E (1985) Congenital nevi < 10 cm as precursors to melanoma. 52 cases, a review, and a new conception. Arch Dermatol 121: 1274-1281.
10. Hundeiker M (1987) Diagnose und Therapie der kongenitalen Pigmentzellnaevi. Dtsch Med Wochenschr 112: 807-809.
11. Kaplan EN (1974) The risk of malignancy in large congenital nevi. Plast Reconstr Surg 53: 421-428.
12. Smolle J, Kaddu S, Kerl H (1999) Non-random spatial association of melanoma and naevi-a morphometric analysis. Melanoma Res 9: 407-412.
13. Alvarez-Mendoza A, Reyes-Esparza J, Ruiz-Maldonado R, Lopez-Corella E, Juarez-Herrera NC (2001) Malignant melanoma in children and congenital melanocytic nevi: DNA content and cell cycle analysis by flow cytometry. Pediatr Dev Pathol 4: 73-81.
14. Papp T, Pemsel H, Zimmermann R, Bastrop R, Weiss DG, Schiffmann D (1999) Mutational analysis of the N-ras, p53, p16INK4a, CDK4, and MC1 R genes in human congenital melanocytic naevi. J Med Genet 36: 610-614.
15. Scalzo DA, Hida CA, Toth G, Sober AJ, Mihm MC Jr (1997) Childhood melanoma: a clinicopathological study of 22 cases. Melanoma Res 7: 63-68.
16. Betti R, lnselvini E, Vergani R, Crosti C (2000) Small congenital nevi associated with melanoma: case reports and considerations. J Dermatol 27: 583-90.
17. Sahin 5, Levin L, Kopf AW, Rao BK, Triola M, Koenig K, Huang C, Bart R (1998) Risk of melanoma in medium-sized congenital melanocytic nevi: a follow-up study. J Am Acad Dermatol 39: 428-433.
18. Barnhill RL, Fleischli M (2001) Histologie features of congenital melanocytic nevi in infants 1 year of age or younger. J Am Acad Dermatol 33: 780-785.
19. Quaba AA, Wallace AF (1986) The incidence of malignant melanoma (0-15 years of age) arising in ,,!arge" congenital nevocellular nevi. J Plast Reconstr Surg 78: 174-181.
20. Egan CL, Oliveria SA, Elenitsas R, Hanson J, Halpern AC (1998)
Cutaneous melanoma risk and phenotypic changes in !arge congenital nevi: a follow-up study of 46 patients. J Am Acad Dermatol 39: 923-932.
21. Marghoob AA. Schoenbach SP, Kopf AW, Orlow SJ, Nossa R, Bart RS (1996) Large congenital melanocytic nevi and the risk for the development of malignant melanoma. A prospective study. Arch Dermatol 132: 170-175.
22. Bohn J, Svensson H, Aberg M (2000) Dermabrasion of !arge congenital melanocytic naevi in neonates. Scand J Plast Reconstr Surg Hand Surg 34: 321-326.
23. Casanova D, Bardot J, Andrac-Meyer L, Magalon G (1998) Early curettage of giant congenital naevi in children. Br J Dermatol 138:341-345.
24. De Raeve LE, Roseeuw DI (2002) Curettage of giant congenital melanocytic nevi in neonates: a decade later. Arch Dermatol 138: 943-947.
25. Rompel R, Moser M, Petres J (1997) Dermabrasion of congenital nevocellular nevi: experience in 215 patients. Dermatology 194: 261-217.
26. Lanier VC, Pickrell KL, Georgiade NG (1976) Congenital giant nevi: Clinical and pathological considerations. Plast Reconstr Surg 58: 48-54.
27. Makkar HS, Frieden IJ (2002) Congenital melanocytic nevi: an update for the pediatrician. Curr Opin Pediatr 14: 397-403.
28. Michel JL, Chalencon F, Gentil-Perret A, Fond L, Montelimard N, Chalencon V, Cambazard F (1999) Congenital pigmented nevus: prognosis and therapeutic possibilities. Arch Pediatr 6: 211-217.
29. DeDavid M, Orlow SJ, Provos! N, Marghoob AA, Rao BK, Huang CL, Wasti Q, Kopf AW, Bart RS (1997) A study of !arge congenital melanocytic nevi and associated malignant melanomas: review of cases in the New York University Registry and the world literature.
J Am Acad Dermatol 36: 409-416.
30. Gosain AK, Santoro TD, Larson DL, Gingrass RP (2002) Giant congenital nevi: a 20-year experience and an algorithm for their management. Plast Reconstr Surg 108: 622-636.
31. Kono T, Ercocen AR, Chan HH, Kikuchi Y, Nozaki M (2002) Effectiveness of the normal-mode ruby laser and the combined (normal-mode plus Q-switched) ruby laser in the treatment of congenital melanocytic nevi: a comparative study. Ann Plast Surg 49: 476-485.
32. Reda AM, Taha IR, Riad HA (1999) Clinical and histological effect of a single treatment of normal mode alexandrite (755 nm) laser on small melanocytic nevi. J Cutan Laser Ther 1: 209-215.
33. Byrd SE, Darling CF, Tomita T, Chou P, de Leon GA, Radkowski MA (1997) MR imaging of symptomatic neurocutaneous melanosis in children. Pediatr Radio! 27: 39-44.
34. Bittencourt FV, Marghoob AA, Kopf AW, Koenig KL, Bart RS (2001) Large congenital melanocytic nevi and the risk for development of malignant melanoma and neurocutaneous melanocytosis. Pediatrics 106: 736-741.
35. Bouton J. (1998) Primary melanoma of the leptomeninges. J Clin Pathol 11: 122-127.
36. Kadonaga JN, Frieden IJ (1991) Neurocutaneous melanosis: definition and review of the literature. J Am Acad Dermatol 24: 747-755.
37. Frieden IJ, Williams ML, Barkovich AJ (1994) Giant congenital melanocytic nevi:
brain magnetic resonance findings in neurologically asymptomatic children. J Am Acad Dermatol 31: 423-429.